Eine merkwürdige Flüssigkeit – Anomalie des Wassers
| Autoren: | |||
| Publikation: | 12.1.2009 | ||
| Lernstufen: | 2, 3 | ||
| Herkunft: | Sonnentaler, Berlin | ||
| Bewertung: |
|
Wasser weist einige erstaunliche Eigenschaften auf. So dehnt es sich – im Gegensatz zu fast allen anderen Flüssigkeiten – beim Einfrieren aus (weswegen Wasserleitungen im Winter manchmal platzen und man keine verschlossenen Flaschen mit Wasser in das Gefrierfach legen sollte). Dies ist die sogenannte Dichte-Anomalie des Wassers.
Diese Unterrichtseinheit dient dazu, dass sich die Kinder mit dieser außergewöhnlichen Eigenschaft des Wassers vertraut machen und diese mit einigen Experimenten erforschen und deren Ursachen spielerisch erkennen lernen.
Ergänzend gibt es zu dieser Unterrichtseinheit eine naturwissenschaftlich fundierte Einführung für Lehrende, die das Phänomen und seine Ursachen genauer erklärt, sowie eine Bechreibung der Stellung im Lehrplan dieses Themenbereichs im (niedersächsischen) Kerncurriculum Sachkunterricht für die Schuljahrgänge 1-4.
Möglicher Ablauf der Unterrichtseinheit
Die Dauer der Stunden beträgt jeweils 90 Minuten, da für die Durchführung der Versuche, für die eine Kältemischung angefertigt werden muss, die Beobachtung des Versuchsergebnisses aufgrund der Dauer des Erstarrungsvorgangs erst nach ungefähr 60 Minuten erfolgen kann.
Anmerkungen für Lehrende
Der Vorteil einer Kältemischung ist, dass die Schüler sehen können, was gerade passiert. Im Kühlschrank geht alles hinter verschlossener Tür vor sich. Wenn Sie in einem Getränkemarkt zerstoßenes Eis (gecrushtes Eis, crushed ice) kaufen, haben Sie sofort größere Mengen Eis und die Kältemischung lässt sich leichter herstellen. Außerdem sollten Sie darauf achten, kein Streusalz zu verwenden, da die Kinder auf die Idee kommen können, das Salz zu probieren.
1. Stunde:
- Einstieg in das Thema mit der Geschichte vom Experiment von Captain Cook, Formulierung einer Fragestellung: "Was passiert mit dem Eis in den Fässern?"
- "Wie kann man das überprüfen?", Entwicklung eines geeigneten Versuchsaufbaus (z. B. Captain-Cook-Experiment)
- Durchführung des Captain-Cook-Experiments und des Experiments "Nordpol im Wasserglas"
- Eintragen des Versuchsaufbaus, der Vermutungen, Beobachtungen und Erklärungen ins Versuchsheft
2. Stunde:
- Formulierung einer Fragestellung: "Was passiert, wenn Wasser in einem geschlossenen Behälter gefriert?"
- "Wie kann man das überprüfen?", Entwicklung eines geeigneten Versuchsaufbaus (z. B. "Eis in der Flasche")
- Durchführung der Experimente "Eis in der Flasche" und "Eis braucht Platz"
- Eintragen des Versuchsaufbaus, der Vermutungen, Beobachtungen und Erklärungen ins Versuchsheft
3. Stunde:
- Formulierung einer Fragestellung: "Dehnen sich alle Stoffe während des Erstarrens aus?", wichtige Anschlussbetrachtung, um Fehlvorstellungen entgegenzuwirken, denn Ziel der Unterrichtseinheit ist, die Anomalie des Wassers zu verdeutlichen
- "Wie kann man das überprüfen?", Entwicklung eines geeigneten Versuchsaufbaus ("Eisberge und Wachstäler")
- Durchführung des Experiments "Eisberge und Wachstäler"
- Eintragen des Versuchsaufbaus, der Vermutungen, Beobachtungen und Erklärungen ins Versuchsheft
4. Stunde:
- Formulierung einer Fragestellung: "Schwimmt Eis in Wasser und was ist mit festem Wachs im flüssigen Wachs?"
- "Wie kann man das überprüfen?", Entwicklung eines geeigneten Versuchsaufbaus ("Tauchende Kerze, schwimmender Eiswürfel")
- Durchführung des Experiments "Tauchende Kerze, schwimmender Eiswürfel"
- Eintragen des Versuchsaufbaus, der Vermutungen, Beobachtungen und Erklärungen ins Versuchsheft
5. Stunde:
- Formulierung einer Fragestellung: "Schwimmen Eiswürfel immer oben?"
- "Wie kann man das überprüfen?", Entwicklung eines geeigneten Versuchsaufbaus ("Tauchende Eiswürfel")
- Durchführung des Experiments "Tauchende Eiswürfel"
- Eintragen des Versuchsaufbaus, der Vermutungen, Beobachtungen und Erklärungen ins Versuchsheft
6. Stunde:
- Einführung des Modells (siehe Einführung für Lehrende), wichtig: Grenzen des Modells zur Vermeidung von Fehlvorstellungen aufzeigen
- Anfertigung der Pfeifenputzermännchen, Zusammenfügen zu Wassermolekülen und Eiskristallen (Ausbildung hexagonaler Ringe in der Ebene und im Raum)
7. Stunde:
- Einführung der gespielten Analogie
- Entwicklung der Spielregeln: Wie sieht ein Wassermolekül aus? [tetraedrische Struktur], wie finden sich die Moleküle zusammen? [Ausbildung von Wasserstoffbrückenbindungen], wie dauerhaft ist die Bindung der Moleküle untereinander im flüssigen und im festen Zustand? [kurzzeitige Verbindung im flüssigen Zustand, dauerhafte Verbindung im festen Zustand]
- Durchführung des Spiels nach den vorher vereinbarten Regeln
1. Stunde
Das Experiment von Captain Cook

Abb. 1: Die "Gorch Fock" zwischen Eisbergen, © Bundeswehr/Bednarzik
Schon immer war für Seefahrer die Versorgung mit frischem Trinkwasser lebenswichtig, denn Meerwasser kann man nicht trinken. Einen besonderen Weg der Trinkwasserversorgung fand 1773 die Expedition von Captain James Cook, die auf ihrer Forschungsreise um die Welt bis ins südliche Eismeer vorgedrungen war. Georg Forster, ein Teilnehmer der Expedition, berichtet:
"Am 9ten des Morgens war eine große Insel von Eis, mit vielen Bruchstücken umgeben, zu sehen, und da wir eben gelindes Wetter hatten, so ward beigelegt und ein Boot ausgesetzt, um von dem losen Eise so viel als möglich aufzufischen. Diese Eisschollen wurden hernach auf das Hinterdeck des Schiffes geworfen, daselbst in Stücken zerschlagen und alsdenn in Fässer gepackt. Nach Tische ließen wir etwas davon in Kesseln schmelzen, und auf das übrige in Fässer gepackte Eis ganz warm ausgießen, damit dieses desto eher zergehen möchte. Das Wasser, welches wir aus dem geschmolzenen Eise erhielten, war völlig süß und schmeckte reiner als das vom Kap [der guten Hoffnung] aus annoch vorrätige [...]
Einige Leute am Bord, die keine Kenntnis von der Naturkunde haben mussten, besorgten in rechtem Ernste, dass das Eis, so bald es schmölze, die [inzwischen verschlossenen] Fässer, worin es gepackt war, sprengen würde. Sie bedachten nicht, dass, da es auf dem Wasser schwimmt, es folglich auch mehr Raum als das Wasser einnehmen müsse. Um ihnen die Augen zu öffnen, ließ der Captain..."
Die Lehrerin wird den Kindern beim "Entziffern" dieses Textes sicherlich
ab und zu helfen müssen. Die Kinder können sich nun zum Beispiel in kleinen
Gruppen überlegen, wie die Geschichte weitergeht. Die verschiedenen Auflösungen
der Geschichte können anschließend der gesamten Klasse vorgetragen und
besprochen werden.
Wie könnte man im Klassenraum nachstellen, was mit den Fässern des
Captain Cook passiert? Es werden alle Vorschläge
gesammelt und diskutiert. Ein mögliches Experiment ist das im Folgenden
beschriebene Captain-Cook-Experiment.
Captain-Cook-Experiment
Material:
- 1 Becher mit gefrorenem Wasser
- (1 Topf mit Wasser)
- (1 Herdplatte)
Versuchsaufbau und –durchführung:
Der Becher mit dem gefrorenen Wasser wird an einen ungestörten Platz gestellt. (Der Becher mit dem gefrorenen Wasser wird in den Topf mit Wasser gestellt. Anschließend wird das Wasser vorsichtig auf dem Herd erhitzt.)
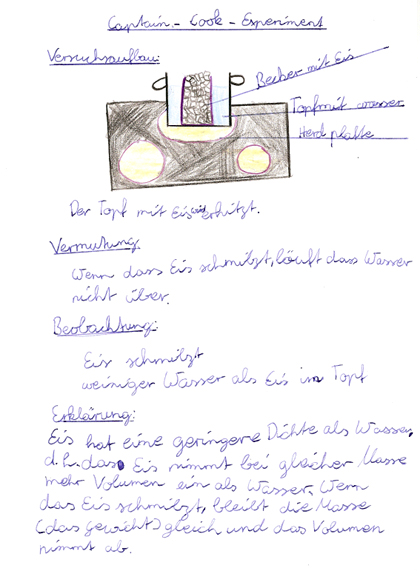
Abb. 2: Ausschnitt aus einem Versuchsheft [2]
Versuchsbeobachtung:
Obwohl kein Wasser überläuft, befindet sich deutlich weniger Wasser im Becher.
Versuchserläuterung:
Eis hat eine geringere Dichte als Wasser, d. h. das Eis nimmt bei gleicher Masse ein größeres Volumen ein als Wasser. Schmilzt das Eis, bleibt die Masse gleich, aber die Dichte wird größer. Deshalb nimmt das Volumen ab.
Captain Cook hat es damals genauso gemacht. Georg Forsters Bericht fährt fort:
"Um ihnen die Augen zu öffnen, ließ der Captain ein Gefäß voller kleinen Eisstücken in eine warme Kajüte stellen, wo es nach und nach schmolz und denn ungleich weniger Raum als zuvor einnahm."

Abb. 3: Captain-Cook-Experiment: Vorher und nachher
Dass Eis eine geringere Dichte als Wasser hat – bei gleicher Masse also mehr Volumen einnimmt –, kann man durch ein weiteres Experiment eindrucksvoll demonstrieren. Da die Kinder wahrscheinlich nicht selber auf das "Nordpol im Wasserglas"-Experiment kommen, kann die Lehrerin ihnen in diesem Fall Versuchsaufbau und -durchführung beschreiben. Die weiteren Schritte (Hypothese aufstellen, Durchführung des Experiments, Diskussion in kleinen Gruppen, schriftliches Festhalten im Versuchsheft) können die Kinder wieder selbständig machen.
Nordpol im Wasserglas
Material:
- 1 Glas
- warmes Wasser
- 1 Eiswürfel
- evtl. Münzen
Versuchsaufbau und -durchführung:
Das warme Wasser wird fast bis zum Rand in das Glas gefüllt. Anschließend wird der Eiswürfel vorsichtig in das Wasser gelegt. Dann wird das Glas entweder durch löffelweises Zugeben von Wasser oder durch behutsam ins Wasser geworfene Münzen bis zum Rand mit Wasser gefüllt.

Abb. 4: Ausschnitt aus einem Versuchsheft
Versuchsbeobachtung:
Der Eiswürfel schmilzt und das Wasser im randvoll gefüllten Glas läuft nicht über.
Versuchserläuterung:
Aufgrund der geringeren Dichte von Eis im Vergleich zum Wasser, nimmt Eis bei gleicher Masse mehr Volumen ein als Wasser. Wenn das Eis unterhalb der Wasseroberfläche schmilzt, nimmt es also ein geringeres Volumen ein als vorher und der Wasserspiegel sinkt. Das Eis, das sich über der Wasseroberfläche befindet, wird ebenfalls zu Wasser, so dass das Glas bis zum Rand gefüllt ist.

Abb. 5: Nordpol im Wasserglas
2. Stunde
Was wäre passiert, wenn in den Fässern flüssiges Wasser gewesen und dieses dann gefroren wäre? Nach einer Diskussion im Rahmen der gesamten Klasse überlegen sich die Kinder, wie sie ihre Annahmen überprüfen können. Mögliche Experimente wären die folgenden.
Eis in der Flasche
Material:
- 1 kleine Glasflasche (100-250 ml) mit festem Schraubverschluss
- Wasser
- kleiner Eimer
- Kältemischung (Mischung aus Eis und Salz im Verhältnis 2:1)
Versuchsaufbau und –durchführung:
Die Glasflasche wird randvoll mit kaltem Wasser gefüllt und anschließend mit dem Schraubverschluss fest verschlossen. Dann wird die Flasche umgekehrt in den Eimer gestellt und vollständig von der Kältemischung umgeben.

Abb. 6: Ausschnitt aus einem Versuchsheft
Versuchsbeobachtung:
Die Flasche zerspringt nach etwa einer Stunde.
Versuchserläuterung:
Wasser nimmt im gefrorenen Zustand ein größeres Volumen ein, d. h. es dehnt sich aus. Da die Glasflasche fest verschlossen ist, zerspringt sie während des Erstarrungsvorgangs.

Abb. 7: Eis in der Flasche
Eis braucht Platz
Material:
- 1 Überraschungsei (gelbes Plastikei)
- 1 Einwegspritze
- Wasser
- Eimer
- Gefrierfach oder Kältemischung (Mischung aus Eis und Salz im Verhältnis 2:1)
Versuchsaufbau und –durchführung:
Das gelbe Plastikei wird vollständig mit Wasser gefüllt, indem beide Hälften in einen mit Wasser gefüllten Eimer getaucht und unter Wasser zusammengesteckt werden. Die Spritze wird mit Wasser aufgezogen und anschließend an der Spitze verschlossen. Anschließend werden das Plastikei und die Spritze in das Gefrierfach bzw. die Kältemischung gestellt.
Versuchsbeobachtung:
Das beiden Hälften des Plastikeis sind auseinandergeschoben und dazwischen ist das Eis zu sehen. An der Skala der Einwegspritze lässt sich eine Volumenzunahme ablesen.
Versuchserläuterung:
Wasser nimmt im gefrorenen Zustand ein größeres Volumen ein, d. h. es dehnt sich aus. Da das Plastikei vollständig mit Wasser gefüllt ist, zerspringt es während des Erstarrungsvorgangs.

Abb. 8: Überraschungseier vor und nach dem Einfrieren
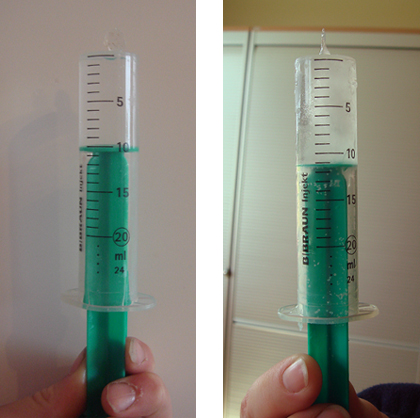
Abb. 9: Einwegspritze vor und nach dem Einfrieren
Alltagsbezug:
Wer hat nicht schon mal die aufgeplatzten Stellen auf einer asphaltierten Straße beobachtet? Durch Risse im Asphalt dringt Wasser unter die Fahrbahn. Dieses gefriert im Winter zu Eis, das mehr Platz braucht als das Wasser und "sprengt" die Asphaltdecke.
3. Stunde
Ist es bei allen Flüssigkeiten so, dass sie im gefrorenen Zustand mehr Platz einnehmen als im flüssigen Zustand? Welche Flüssigkeiten – außer Wasser und solchen Flüssigkeiten, die zum größten Teil aus Wasser bestehen (Milch, Limonade usw.) – sind den Kindern noch sehr vertraut? Haben die Kinder bei einer Kerze schon einmal beobachtet, was mit dem flüssigen Wachs um den Docht herum passiert, nachdem man die Kerze ausgepustet hat? Wie könnte man überprüfen, was mit diesen "anderen" Flüssigkeiten passiert?
Die Lehrerin schreibt die Vorschläge der Kinder an die Tafel. Die einzelnen Vorschläge werden anschließend im Rahmen der gesamten Klasse diskutiert. Ein mögliches Experiment wäre zum Beispiel das folgende.
Eisberge und Wachstäler
Material:
- 2 Metalldeckel von Sprudelflaschen
- geschmolzenes Wachs
- Wasser
- Gefrierfach oder Kältemischung (Mischung aus Eis und Salz im Verhältnis 2:1)
Versuchsaufbau und –durchführung:
In den einen Metalldeckel wird bis zum Rand flüssiges Wachs gefüllt und in den anderen Metalldeckel Wasser. Während der mit flüssigem Wachs gefüllte Metalldeckel bei Zimmertemperatur beobachtet wird, wird der mit Wasser gefüllte Metalldeckel in ein Gefrierfach oder die Kältemischung gestellt. Dabei ist zu beachten, dass der Metalldeckel nicht auf wärmeisolierendes Material gestellt wird, sondern auf den Boden des Gefrierfachs oder auf bereits Gefrorenes, das sehr viel Wasser enthält.

Abb. 10: Ausschnitt aus einem Versuchsheft
Versuchsbeobachtung:
Während das erstarrte Wachs im Metalldeckel nach unten gewölbt ist, ist das Eis nach oben gewölbt.
Versuchserläuterung:
Wenn das Wachs erstarrt, nimmt es ein kleineres Volumen ein als im flüssigen Zustand, d. h. der Flüssigkeitsspiegel sinkt während des Erstarrungsvorgangs und es entsteht eine Mulde im Wachs. Im Gegensatz dazu nimmt Wasser, wenn es erstarrt, ein größeres Volumen ein, d. h. der Flüssigkeitsspiegel steigt während des Erstarrungsvorgangs, so dass ein Eisberg entsteht.

Abb. 11: Eisberge und Wachstäler
4. Stunde
"Die tauchende Kerze und der schwimmende Eiswürfel" ist ein weiteres Experiment, mit dem man zeigen kann, dass sich Wasser anders verhält als andere Flüssigkeiten. Vielleicht gehört es bereits zu den Experimenten, die die Kinder am Anfang der 3. Stunde vorgeschlagen haben. Wenn nicht, kann die Lehrerin die Kinder nochmal explizit auf die schwimmenden Eiswürfel im Wasser hinweisen (Unterrichtsstunde 1). Wahrscheinlich kommen die Kinder dann ganz von allein darauf auszuprobieren, was mit festem Wachs in flüssigem Wachs passiert – oder mit gefrorenen Ölwürfeln in Öl.
Wenn Sie das Experiment mit Öl durchführen wollen, sollten Sie das Öl in eine flache Schale gießen. Die Konsistenz von gefrorenem Öl entspricht eher der Konsistenz von Speiseeis (zumindest bei den Temperaturen, die in einem Gefrierfach herrschen), sodass es am einfachsten ist, mit einem Teelöffel kleine "Ölportionen" aus der gefrorenen Masse zu entnehmen. Das Experiment sollte auch relativ schnell durchgeführt werden, da das gefrorene Öl sehr schnell schmilzt.
Tauchende Kerze, schwimmender Eiswürfel
Material:
- 2 Gläser
- Wasser
- Eiswürfel
- flüssiges Wachs
- Kerzenstummel
Versuchsaufbau und -durchführung:
In das eine Glas wird Wasser und in das andere Glas flüssiges Wachs gefüllt. Anschließend wird ein Eiswürfel in das Wasserglas und ein Kerzenstummel in das Glas mit dem flüssigen Wachs gegeben.

Abb. 12: Ausschnitt aus einem Versuchsheft
Versuchsbeobachtung:
Während der Eiswürfel im Wasser schwimmt, geht der Kerzenstummel im flüssigen Wachs unter.
Versuchserläuterung:
Eis hat eine geringere Dichte als Wasser und schwimmt deshalb oben. Festes Wachs hat eine größere Dichte als flüssiges Wachs, deshalb geht es unter.

Abb. 13: Tauchende Kerze, schwimmender Eiswürfel
5. Stunde
Die Lehrerin stellt den Kindern eine "schwierige" Frage: "Habt ihr eine Idee, wie man die Eiswürfel zum Tauchen bringen könnte?" Auch diesmal schreibt die Lehrerin die Vorschläge wieder an die Tafel und lässt die Kinder darüber diskutieren. Vielleicht ist auch folgender Versuch dabei.
Tauchende Eiswürfel
Material:
- Wasser
- Öl
- 3 Eiswürfel
- 3 Gläser
Versuchsaufbau und –durchführung:
Zwei der Gläser werden jeweils zu einem Drittel mit Wasser bzw. Öl gefüllt. In das dritte Glas wird zunächst Wasser und anschließend Öl gefüllt. Danach werden die Eiswürfel vorsichtig in die Gläser gelegt.

Abb. 14: Ausschnitt aus einem Versuchsheft
Versuchsbeobachtung:
In dem mit Wasser gefüllten Glas schwimmt der Eiswürfel. In dem mit Öl gefüllten Glas geht der Eiswürfel unter. In dem mit Wasser und Öl gefüllten Glas durchdringt der Eiswürfel das Öl und kommt an der Grenzschicht zur Ruhe.
Versuchserläuterung:
Eis hat eine geringere Dichte als Wasser und schwimmt deshalb oben. Ebenso hat Öl eine geringere Dichte als Wasser, denn es schwimmt ebenfalls auf dem Wasser. Der Vergleich der Dichte der drei unterschiedlichen Stoffe zeigt, dass Wasser mit 0,998206 g/cm³ bei 20°C die größte Dichte hat. Eis hat bei 0°C eine Dichte von 0,918 g/cm³ und Öl eine Dichte von 0,914 g/cm³. Da Öl eine geringere Dichte als Eis hat, sinkt der Eiswürfel in Öl zu Boden bzw. in der geschichteten Flüssigkeit bis zur Grenzschicht zwischen Wasser und Öl.

Abb. 15: Tauchende Eiswürfel
6. Stunde
Diese Stunde dient dazu, den Kindern näher zu veranschaulichen, weshalb sich Wasser "anomal" verhält. Es ist hier natürlich auch wieder denkbar, dass die Kinder – in kleinen Gruppen aufgeteilt – zunächst selbst in Sachbüchern und im Internet versuchen etwas über das Wassermolekül in Erfahrung zu bringen. Wenn die Zeit knapp ist, kann die Lehrerin diese und die folgende Stunde einfach wie beschrieben durchführen.
Pfeifenputzermodell
Als Modellvorstellung für den Aufbau eines Wassermoleküls wird der menschliche Körper gewählt. Hierbei sind die Hände die beiden Wasserstoffatome und die Füße die freien Elektronenpaare des Sauerstoffs. Stellt man sich dann mit auseinandergestellten Beinen, einer Drehung in der Hüfte um 90° und ausgestreckten Armen hin, ergibt sich eine tetraedrische Gestalt. Zur Veranschaulichung der Wasserstoffbrückenbindung kann eine Hand jeweils einen Fuß ergreifen.
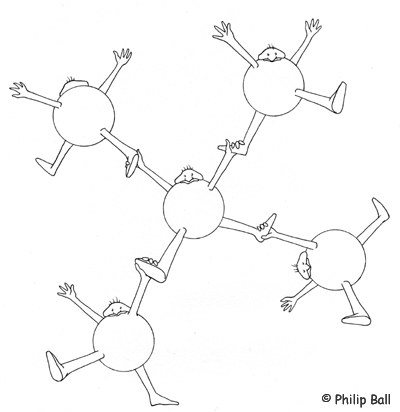
Abb. 16: Skizze der sich an Händen und Füßen haltenden "Wasser-Moleküle" (© Philip Ball)
Während der Unterrichtseinheit wird zunächst anhand von Männchen aus Pfeifenputzern das Modell für ein Wassermolekül erläutert, da diese beweglicher sind als der menschliche Körper, wenn es darum geht, einen Winkel von 105° mit auseinandergestellten Beinen zu verwirklichen, und außerdem die räumliche Struktur im Eis besser dargestellt werden kann.
Material:
- Pfeifenputzer in drei unterschiedlichen Farben

Abb. 17: Pfeifenputzermodell

Abb. 18: Darstellung von Wasser (ungeordnete Anordnung der Moleküle)

Abb. 19: Darstellung von Eis (Ausbildung hexagonaler Ringe in der Ebene und im Raum)
7. Stunde
Gespielte Analogie
Die gespielte Analogie stellt eine Brücke zur Lebenswelt der Schülerinnen und Schüler dar. Sie berücksichtigt dabei die individuellen kognitiven Strukturen, wenn sie von den Schülerinnen und Schülern selbst erfunden und gespielt wird. Außerdem wirkt sie durch die aktive Einbeziehung der Kinder sehr motivierend. Wichtig bei der Verwendung von gespielten Analogien ist wiederum die Diskussion der Grenzen und Probleme der Analogie, um keine Fehlvorstellungen hervorzurufen.

Abb. 20: Gespielte Analogie (Darstellung von Eis – Ausbildung hexagonaler Ringe in der Ebene)
Diese Unterrichtseinheit enstand an der TU Braunschweig im Rahmen der Bachelorarbeit von Melanie Schultalbers in der Arbeitsgruppe für Physikdidaktik von Prof. Dr. Rainer Müller.
Fußnoten
1:
Eine Kältemischung ist eine Mischung aus Eis und Salz im Verhältnis
2 zu 1. Wenn man Eis und Salz gut verrührt, kann das
Eis-Wasser-Salz-Gemisch bis zu ca. −20 °C kalt werden.
In der Kältemischung laufen zwei Prozesse ab: Der dünne Wasserfilm an der
Eisoberfläche löst das Salz auf und das Eis schmilzt. Für beide Vorgänge
wird Energie benötigt, die der Umgebung entzogen wird. Das Gemisch kühlt
sich ab.
2: Dieser und die weiteren abgebildeten Auszüge aus Versuchsheften sind die gemeinsam erarbeiteten Versuchsprotokolle. Die Kinder sollten aber unbedingt auch ihre eigenen Gedanken und Ideen schriftlich festhalten bzw. diejenigen der Gruppe. Siehe dazu auch die Ausführungen zum Versuchsheft in der pädagogischen Dokumentation.
Letzte Aktualisierung: 24.3.2025







